Glutamat (neurotransmitator): definiție și funcții
glutamat mediază cele mai multe sinapse excitatorii ale sistemului nervos central (CNS). Este mediatorul principal al informațiilor senzoriale, motorii, cognitive, emoționale și intervine în formarea amintirilor și în recuperarea lor, fiind prezentă în 80-90% din sinapsele creierului.
În cazul în care este puțin merit, toate acestea intervin și în neuroplasticitate, în procesele de învățare și este precursorul GABA - principalul neurotransmițător inhibitor al CNS -. Ce altceva poate fi cerută o moleculă?
Ce este glutamatul?
probabil a fost unul dintre cei mai extensiv studiat neurotransmițători în sistemul nervos . În ultimii ani, studiul său a crescut din cauza relației sale cu diferite patologii neurodegenerative (cum ar fi boala Alzheimer), care a făcut ca acesta să fie un obiectiv farmacologic puternic în diferite boli.
De asemenea, trebuie menționat faptul că, având în vedere complexitatea receptorilor, acesta este unul dintre cei mai complicați neurotransmițători de studiu.
Procesul de sinteză
Procesul de sinteză a glutamatului are început în ciclul Krebs sau în ciclul de acizi tricarboxilici. Ciclul Krebs este o cale metabolică sau, pentru a înțelege, o succesiune de reacții chimice pentru a produce respirația celulară în mitocondrii . Un ciclu metabolic poate fi înțeles ca mecanismul unui ceas, în care fiecare unelte îndeplinește o funcție, iar eșuarea simplă a unei piese poate determina ceasul să strică sau să nu marcheze bine timpul. Ciclurile din biochimie sunt aceleași. O moleculă, prin intermediul reacțiilor enzimatice continue - trepte de viteză - își schimbă forma și compoziția cu scopul de a da naștere unei funcții celulare. Precursorul principal al glutamatului va fi alfa-ketoglutaratul, care va primi un grup amino prin transaminare pentru a deveni glutamat.
De asemenea, merită menționat un alt precursor destul de semnificativ: glutamina. Atunci când celula eliberează glutamatul în spațiul extracelular, astrocitele - un tip de celulă glială - recuperează acest glutamat, care, printr-o enzimă numită glutamină sintetază, va deveni glutamină. apoi, astrocitele eliberează glutamina, care este recuperată din nou de către neuronii care urmează să fie transformați înapoi în glutamat . Și, eventual, mai multe vor cere următoarele: Și dacă trebuie să returneze glutamina înapoi la glutamat în neuron, de ce astrocitele transformă glutamina în glutamat slab? Și eu nu știu. Poate că astrocitele și neuronii nu sunt de acord sau poate că neuroștiința este complicată. În oricare dintre cazuri, am vrut să revizuiască astrocitele, deoarece colaborarea lor reprezintă 40% din cifra de afaceri de glutamat, ceea ce înseamnă că cea mai mare parte a glutamatului este recuperată de către aceste celule gliale .
Există alți precursori și alte căi prin care se recuperează glutamatul care este eliberat în spațiul extracelular. De exemplu, există neuroni care conțin un transportor specific al glutamatului -EAAT1 / 2- care recuperează direct glutamatul la neuron și permite ca semnalul excitațional să se termine. Pentru studierea în continuare a sintezei și a metabolismului glutamatului, vă recomandăm citirea literaturii.
Receptorii de glutamat
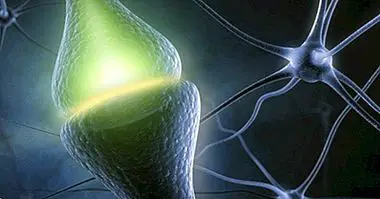
Așa cum ne sunt adesea învățați, fiecare neurotransmitator are receptorii săi în celula postsynaptică . Receptorii, localizați în membrana celulară, sunt proteine la care se leagă un neurotransmițător, hormon, neuropeptid etc., pentru a determina o serie de modificări în metabolismul celular al celulei în care este localizată în receptor. În neuroni, de obicei, plasăm receptorii în celulele postsynaptice, deși nu trebuie să fie așa în realitate.
Suntem de asemenea învățați în prima cursă că există două tipuri de receptori principali: ionotropi și metabotropi. Ionotropicile sunt cele în care, atunci când liantul lor este legat - "cheia" receptorului - ei deschid canalele care permit trecerea ionilor în celulă. Metabotropica, pe de altă parte, atunci când ligandul este legat, provoacă schimbări în celulă prin intermediul unor mesageri secundari. În această analiză voi vorbi despre principalele tipuri de receptori ionotropici ai glutamatului, deși recomand să studiez bibliografia pentru cunoașterea receptorilor metabotropici. Aici citez principalii receptori ionotropici:
- Receptor NMDA.
- Receptor AMPA.
- Receptor Kainado.
Receptorii NMDA și AMPA și relația lor strânsă
Se crede că ambele tipuri de receptori sunt macromolecule formate din patru domenii transmembranare - adică ele sunt formate din patru subunități care traversează bilayerul lipidic al membranei celulare - și ambii sunt receptori de glutamat care vor deschide canale de cationi încărcate pozitiv. Dar, chiar și așa, ele sunt semnificativ diferite.
Una dintre diferențele lor este pragul la care sunt activate. În primul rând, receptorii AMPA sunt mult mai rapizi pentru activare; în timp ce receptorii NMDA nu pot fi activi până când neuronul nu are un potențial de membrană de aproximativ -50mV - un neuron atunci când este inactivat este de obicei în jur de -70mV. În al doilea rând, cationii pasi vor fi diferiți în fiecare caz. Receptorii AMPA realizează potențiale mult mai mari ale membranelor decât receptorii NMDA, care se conectează mult mai modest. In schimb, receptoarele NMDA vor realiza activitati mult mai sustinute in timp decat cele ale AMPA. Prin urmare, cele ale AMPA sunt activate rapid și produc potențiale excitatorii mai puternice, dar sunt dezactivate rapid . Iar cele ale NMDA sunt activate lent, dar reușesc să păstreze potențialul excitator pe care îl generează mult mai mult.
Pentru a înțelege mai bine, să ne imaginăm că suntem soldați și că armele noastre reprezintă diferiții receptoare. Imaginați-vă că spațiul extracelular este o șanț. Avem două tipuri de arme: revolver și grenade. Grenadele sunt simple și rapide de utilizat: eliminați inelul, benzile și așteptați să explodeze. Au o mulțime de potențial distructiv, dar odată ce le-am aruncat pe toate, sa terminat. Revolverul este o armă care ia timp să se încarce pentru că trebuie să scoateți tamburul și să puneți gloanțele unul câte unul. Dar odată ce l-am încărcat, avem șase focuri cu care putem supraviețui pentru o vreme, deși cu un potențial mult mai mic decât o grenadă. Revolverele creierului sunt receptoarele NMDA, iar grenadele noastre sunt cele AMPA.
Excesele glutamatului și pericolele acestuia
Ei spun că în exces nimic nu este bun și în cazul glutamatului este îndeplinită. atunci vom menționa unele patologii și probleme neurologice în care este legat un exces de glutamat .
1. Analogii glutamatului pot determina exotoxicitate
Medicamentele asemănătoare cu glutamatul - adică au aceeași funcție ca și glutamatul - ca NMDA - la care îi datorează receptorul NMDA - poate provoca efecte neurodegenerative în doze mari în regiunile cele mai vulnerabile ale creierului cum ar fi nucleul arcuat al hipotalamusului. Mecanismele implicate în această neurodegenerare sunt diverse și implică diferite tipuri de receptori de glutamat.
2. Unele neurotoxine pe care le putem ingera în dieta noastră exercită moartea neuronală prin excesul de glutamat
Diferitele otrăvuri ale unor animale și plante își exercită efectele prin căile nervoase ale glutamatului. Un exemplu este otravă de semințe de Cycas Circinalis, o plantă otrăvitoare pe care o putem găsi pe insula din Guam. Această otrăvire a provocat o mare prevalență a sclerozei laterale amiotrofice pe această insulă, în care locuitorii ei l-au ingerat zilnic crezând că este benign.
3. Glutamatul contribuie la moartea neuronală prin ischemie
Glutamatul este principalul neurotransmițător al tulburărilor cerebrale acute, cum ar fi infarctul miocardic , stop cardiac, hipoxie pre / perinatală. În aceste evenimente în care există o lipsă de oxigen în țesutul cerebral, neuronii rămân într-o stare de depolarizare permanentă; din cauza diferitelor procese biochimice. Aceasta duce la eliberarea permanentă a glutamatului din celule, cu activarea ulterioară a receptorilor de glutamat. Receptorul NMDA este deosebit de permeabil la calciu comparativ cu alți receptori ionotropici, iar excesul de calciu duce la moartea neuronală. Prin urmare, hiperactivitatea receptorilor glutamatergici conduce la moartea neuronală datorată creșterii calciului intraneuronal.
4. Epilepsia
Relația dintre glutamat și epilepsie este bine documentată. Se consideră că activitatea epileptică este în special legată de receptorii AMPA, deși progresează epilepsia, receptorii NMDA devin importanți.

Este glutamatul bun? Este glutamatul rău?
De obicei, atunci când se citește acest tip de text, se termină umanizarea moleculelor prin etichetarea lor "bun" sau "rău" - care are un nume și se numește antropomorfism, foarte înapoi la modă în vremurile medievale. Realitatea este departe de aceste judecăți simpliste.
Într-o societate în care am generat un concept de "sănătate", este ușor ca unele dintre mecanismele naturii să ne facă neconfortabile. Problema este că natura nu înțelege "sănătatea". Am creat asta prin medicină, industria farmaceutică și psihologia. Este un concept social și, ca orice concept social, este supus progresului societăților, fie el uman sau științific. Progresele arată că glutamatul este legat de un număr bun de patologii cum ar fi Alzheimer sau Schizofrenie.Acesta nu este un ochi rău al evoluției la ființa umană, ci mai degrabă o nepotrivire biochimică a unui concept pe care natura încă nu îl înțelege: societatea umană în secolul XXI.
Și ca întotdeauna, de ce să studiezi asta? În acest caz, cred că răspunsul este foarte clar. Datorită rolului glutamatului în diverse patologii neurodegenerative, acesta are ca rezultat o țintă farmacologică importantă - dar de asemenea complexă - . Câteva exemple ale acestor boli, deși nu am vorbit despre ele în această revizuire, deoarece cred că ați putea scrie o intrare exclusiv pe această temă, sunt boala Alzheimer și schizofrenia. În mod subiectiv, mi se pare că căutarea de noi medicamente pentru schizofrenie este deosebit de interesantă, în principal din două motive: prevalența acestei boli și costurile de sănătate implicate; și efectele adverse ale antipsihoticelor curente care, în multe cazuri, împiedică aderența terapeutică.
Text editat și editat de Frederic Muniente PeixReferințe bibliografice:
cărți:
- Siegel, G. (2006). Neurochimia de bază. Amsterdam: Elsevier.
articole:
- Citri, A. și Malenka, R. (2007). Synaptic plasticity: multiple forms, funcții și mecanisme, Neuropsychopharmacology, 33 (1), 18-41. //dx.doi.org/10.1038/sj.npp.1301559
- Hardingham, G. și Bading, H. (2010). Signalizare sinaptică versus extrasinaptică a receptorului NMDA: implicații pentru tulburările neurodegenerative. Nature Reviews Neuroscience, 11 (10), 682-696. //dx.doi.org/10.1038/nrn2911
- Hardingham, G. și Bading, H. (2010). Signalizare sinaptică versus extrasinaptică a receptorului NMDA: implicații pentru tulburările neurodegenerative. Nature Reviews Neuroscience, 11 (10), 682-696. //dx.doi.org/10.1038/nrn2911
- Kerchner, G. și Nicoll, R. (2008). Sintaxele silențioase și apariția unui mecanism postsynaptic pentru LTP. Nature Reviews Neuroscience, 9 (11), 813-825. //dx.doi.org/10.1038/nrn2501
- Papouin, T. și Oliet, S. (2014). Organizarea, controlul și funcționarea receptorilor NMDA extrasinaptici. Tranzacții ficosofice ale Societății Regale B: Biological Sciences, 369 (1654), 20130601-20130601. //dx.doi.org/10.1098/rstb.2013.0601